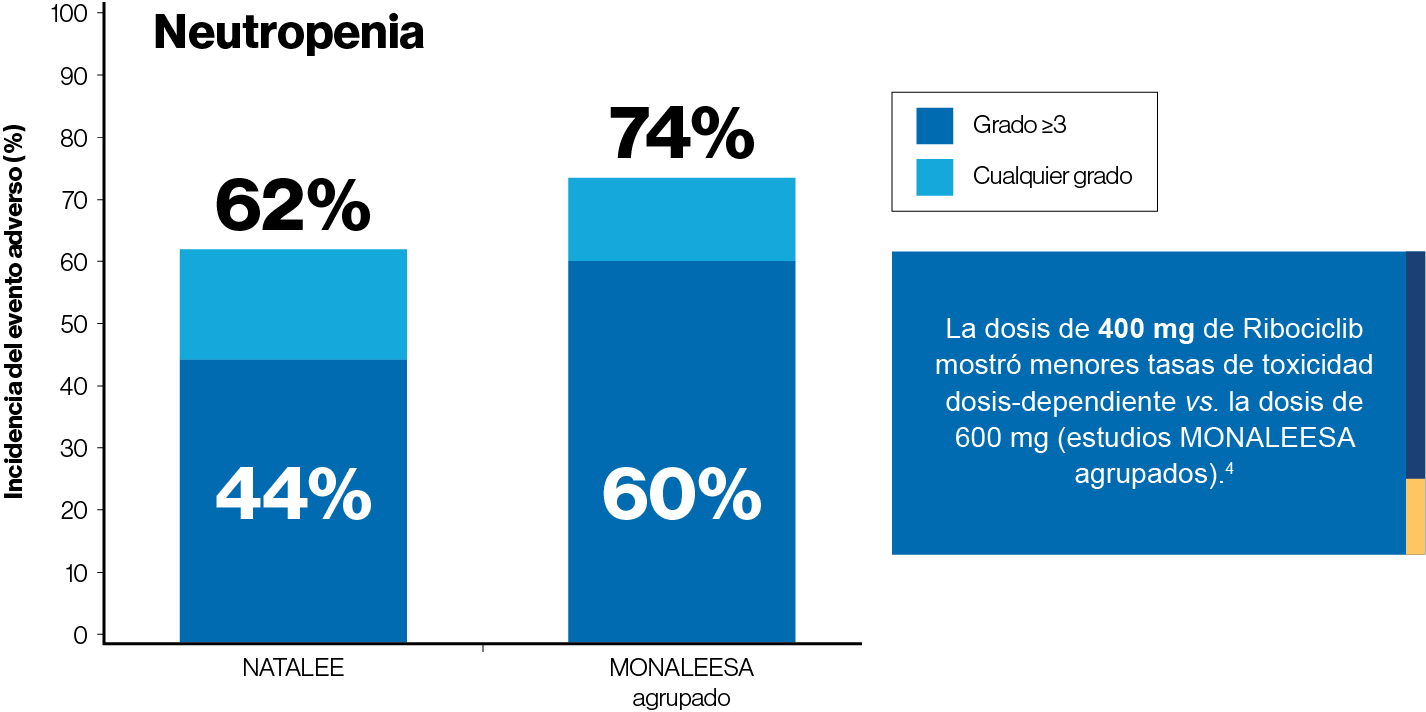
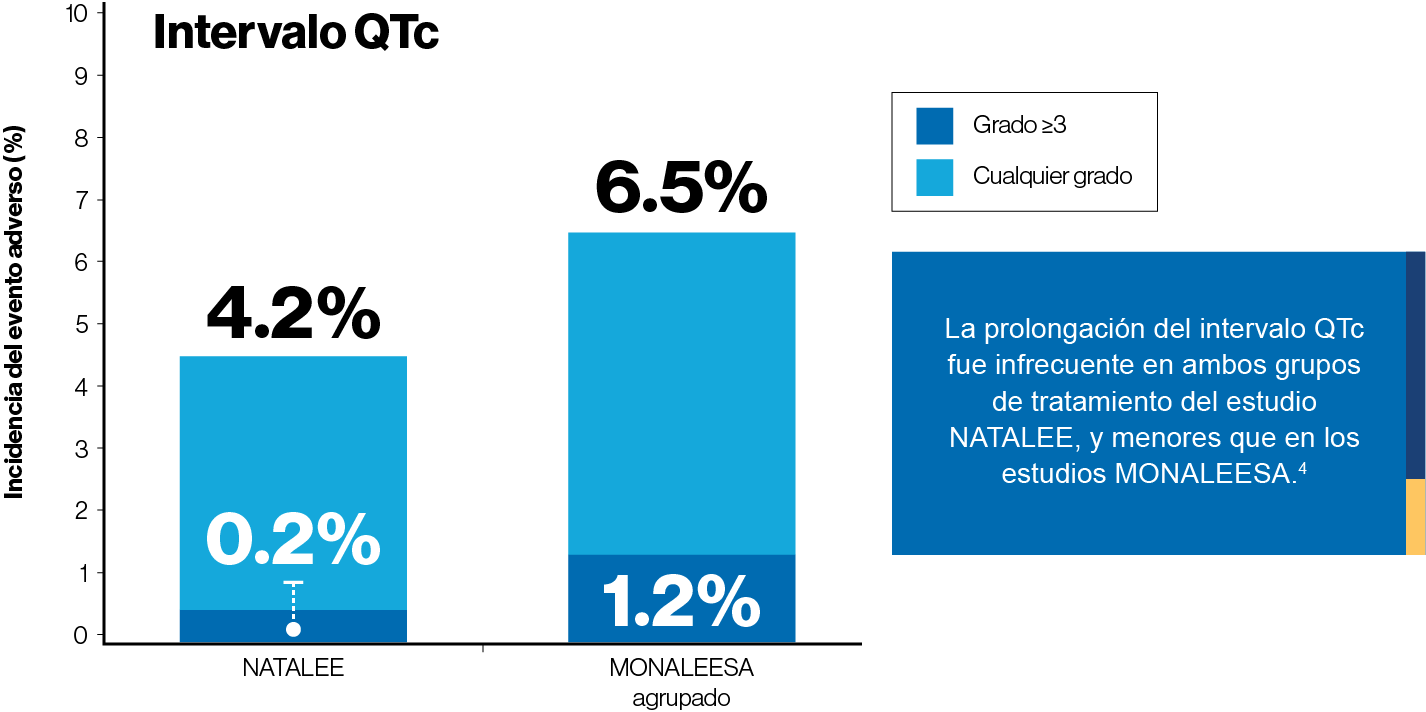
La dosis de 400 mg de ribociclib fue segura y bien tolerada.
Los eventos adversos más frecuentes que condujeron a la descontinuación fueron:
- EA hepáticos (8.9% con ribociblib + NSAI, 0.1% con NSAI solo)
- Artralgia (1.3% con ribociblib + NSAI, 1.1% con NSAI solo)
La mediana de descontinuación por EA ocurrió en los primeros 4 meses.4
Los eventos adversos de especial importancia (neutropenia y prolongación del QTc) fueron observados con menor frecuencia que en los estudios MONALEESA.4
Referencias:
1. Lopez-Tarruella S, Echavarria I, Jerez Y, et al. How we treat HR-positive, HER2-negative early breast cancer. Future Oncol. 2022;18(8):1003-22.
2. Slamon DJ, Fasching PA, Hurvitz S, et al. Rationale and trial design of NATALEE: a Phase III trial of adjuvant ribociclib + endocrine therapy versus endocrine therapy alone in patients with HR+/HER2- early breast cancer. Ther Adv Med Oncol. 2023;15:17588359231178125. doi: 10.1177/17588359231178125.
3. Cedolini C, Bertozzi S, Londero AP, et al. Type of breast cancer diagnosis, screening, and survival. Clin Breast Cancer. 2014;14(4):235-40.
4. Slamon DJ, Stroyakovskiy D, Yardley DA, et al. Ribociclib and endocrine therapy as adjuvant treatment in patients with HR+/HER2− early breast cancer: primary results from the Phase III NATALEE trial. Presentado en ASCO 2023. [Póster LBA500].